






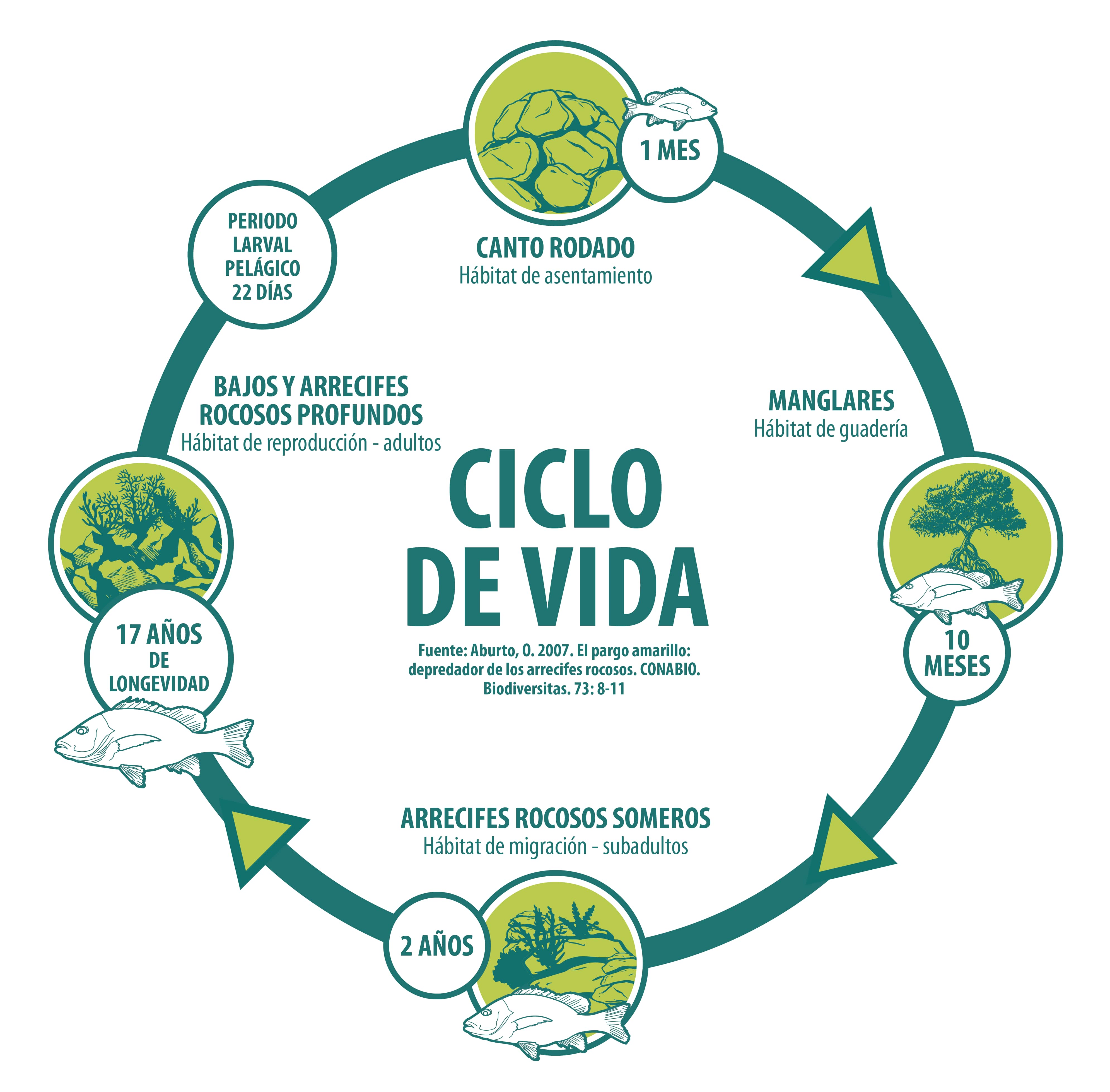




Capturas históricas
Erisman y colaboradores (2010) analizaron datos pesqueros de 3 oficinas de pesca (Santa Rosalía, Loreto y La Paz) de 29 recursos capturados en la parte sur del Golfo de California en el periodo 1999 a 2007. Encontraron que la pesquería del pargo amarillo ocupa el tercer lugar en orden de importancia con una captura promedio anual de 156.4 toneladas en dicho periodo (el 8.8% de la producción pesquera total) (17). De acuerdo con los datos de la CONAPESCA, del 2001 al 2018 se han registrado fluctuaciones importantes. Al inicio del periodo, las capturas no sobrepasaron las 5 t, pero a partir del 2005 las capturas ascendieron a más de 300 t. El registro histórico presenta dos picos máximos: en el 2009 con 270.4 t; y en el 2018 con 318.2 t (15). Del 2001 al 2018 se han capturado en total 2,669 toneladas, siendo Baja California Sur, Jalisco y Nayarit quienes aportaron el 94% de las capturas (2,510 t) (15).
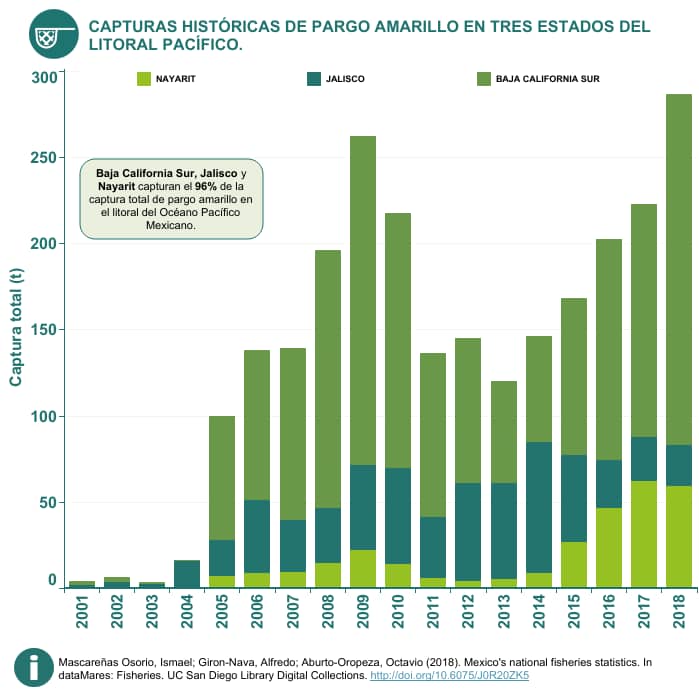
Capturas por mes
De acuerdo con los datos de la CONAPESCA, los meses más importantes son mayo y junio, con capturas promedio de 286 y 302 t respectivamente. Las capturas promedio mensual durante el periodo 2001-2018 fueron de 222 t (15)
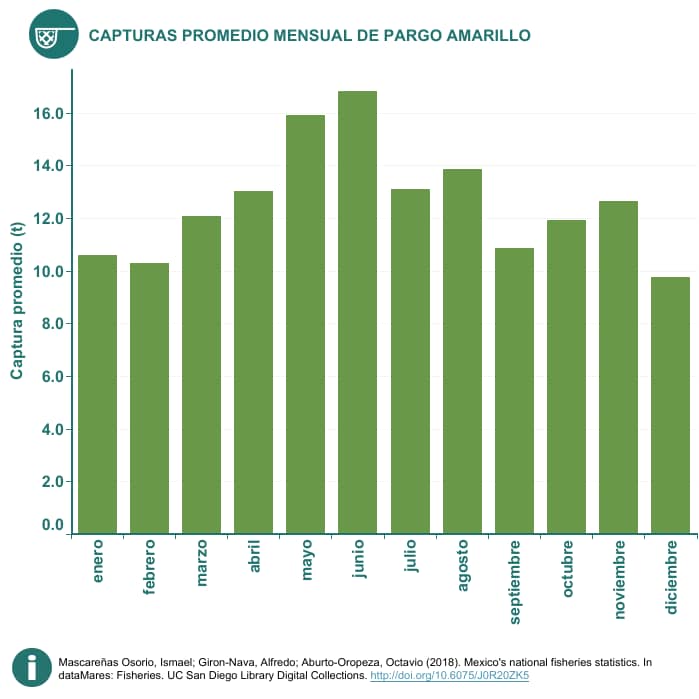
















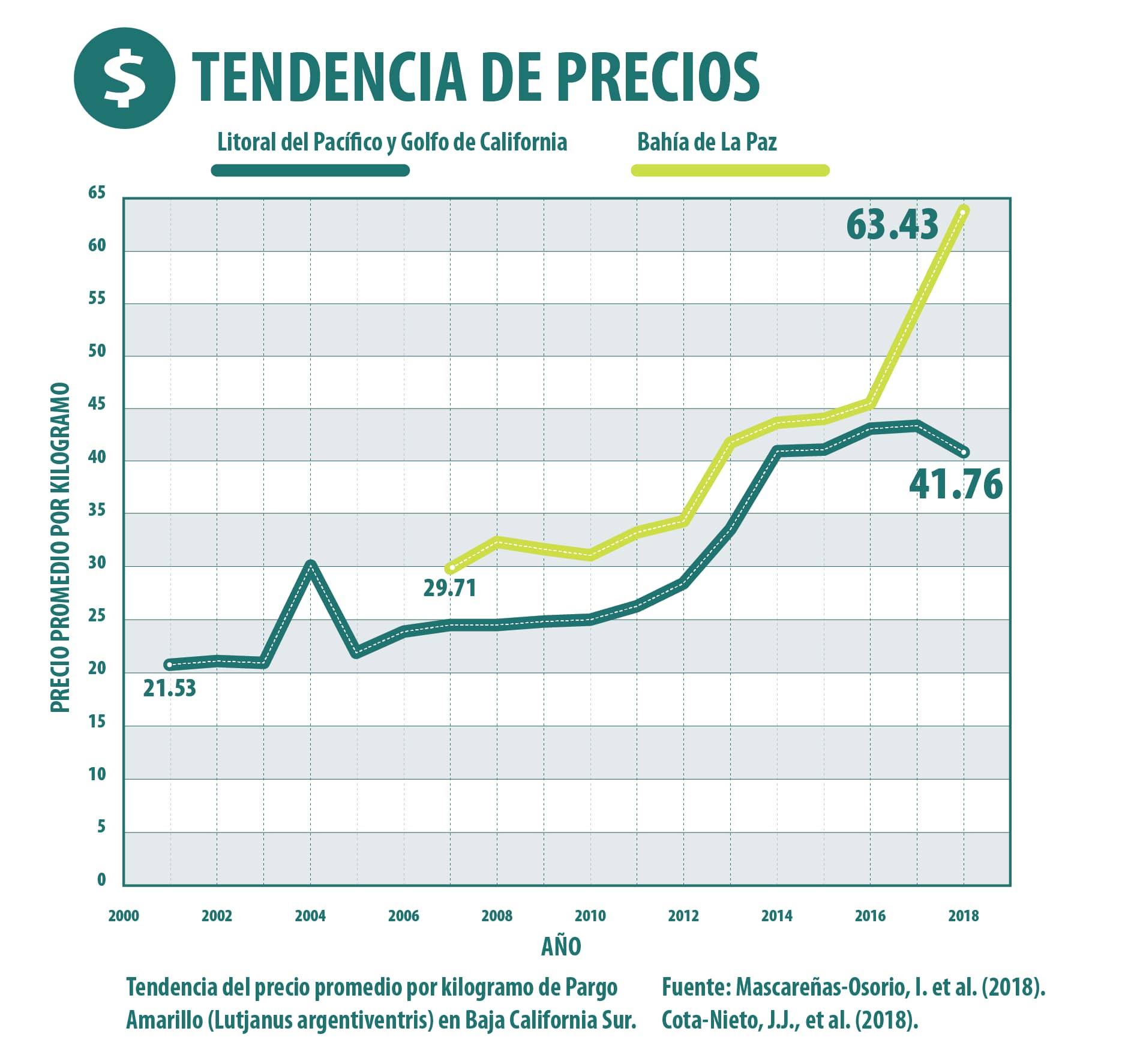


Actualmente no hay medidas de manejo específicas para la pesquería del pargo amarillo, sin embargo, en la Carta Nacional Pesquera (CNP) se estableció que el recurso de escama marina en el Litoral Pacífico se considera aprovechado al máximo sustentable, (5).
Food and Agriculture Organization of the United Nations. 2007. Identification guide.
Smithsonian Tropical Research Institute (STRI). 2016. Peces Costeros del Pacífico Oriental Tropical: un sistema de información en línea. www.stri.org/sftep
Vázquez, R.I., Rodríguez, J., Abitia, L.A. y Galván, F. 2008. Food habits of the yellow snapper Lutjanus argentiventris (Peters, 1869) (Percoidei: Lutjanidae) in La Paz Bay, Mexico. Revista de Biología Marina y Oceanografía. 43(2): 295-302.
Aburto-Oropeza, O., Dominguez-Guerrero, I., Cota-Nieto, J.J. y Plomozo-Lugo, T. 2009. Recruitment and ontogenetic habitat shifts of the yellow snapper (Lutjanus argentiventris) in the Gulf of California. Mar Biol. 156: 2461-2472. DOI 10.1007/s00227-009-1271-5
Diario Oficial de la Federación. 2018. Acuerdo por el cual se da a conocer la actualización de la Carta Nacional Pesquera. 69 p.
Lucano-Ramírez, G., Ruiz-Ramírez, S., Gónzalez-Sansón, G. y Ceballos-Vázquez, B.P. 2014. Biología reproductiva del pargo alazán, Lutjanus argentiventris (Pisces, Lutjanidae), en el Pacífico central mexicano. Ciencias Marinas. 40(1): 33-44
Cruz-Romero, M., Chávez, E.A., Espino, E. and García, A. 1996. Assessment of a snapper complex (Lutjanus spp.) of the eastern tropical Pacific. En: Arreguín-Sánchez, F., Munro, J.L., Balgos, M.C. and Pauly, D. (eds.) Biology, fisheries and culture of tropical groupers and snappers. ICLARM Conf. Proc. No. 48. Manila. 324-330 p.
Rojas, P.A., Gutiérrez, C.F., Puentes, V., Villa, A.A. y Rubio. A. 2004. Aspectos de la biología y dinámica poblacional del pargo coliamarillo Lutjanus argentiventris en el Parque Nacional Nataural Gorgona, Colombia. Investigaciones Marinas, Valparaíso. 32(2): 23-36.
Ahern, A.L.M., Gómez-Gutiérrez, J., Aburto-Oropeza, O., Saldierna-Martínez, R.J., Johnson, A.F., Harada, A.E., Sánchez-Uvera, A.R., Erisman, B., Castro-Arvizu, D.I., Burton, R.S. 2018. DNA sequencing of fish eggs and larvae reveals high species diversity and seasonal changes in spawning activity in the southeastern Gulf of California. Marine Ecology Progress Series. Vol. 592: 159-179
Piñón, A., Amezcua, F. and Duncan, N. 2009. Reproductive cycle of female yellow snapper Lutjanus argentiventris (Pisces, Actinopterygii, Lutjanidae) in the SW Gulf of California: gonadic stages, spawning seasonality and length at sexual maturity. J. Appl. Ichthyol. 25: 18-25
Aburto, O. 2007. El pargo amarillo: depredador de los arrecifes rocosos. CONABIO. Biodiversitas. 73: 8-11
Sala, E., Aburto-Oropeza, O., Paredes, G. and Thompson, G. 2003. Spawning aggregations and reproductive behavior of reef fishes in the Gulf of California. Bulletin of Marine Science. 20p
TinHan, T., Erisman, B., Aburto-Oropeza, O., Weaver, A., Vázquez-Arce, D. y Lowe, C.G. 2014. Residency and seasonal movements in Lutjanus argentiventris and Mycteroperca rosacea at Los Islotes Reserve, Gulf of California. Marine Ecology. Prog. Ser. 501:191-206. https://doi.org/10.3354/meps10711
Aburto-Oropeza, O., Dominguez-Guerrero, I., Cota-Nieto, J., Sala, E. and Hinojosa-Arango, G. he Contributio of Mangroves Ecosystemns to the Replenishment of Reef Fish Populations and Fisheries in the Gulf of California: The Effects of Mangrove Areas and Their Structure. Eds: Riosmena-Rodriguez, R., López-Vivas, J.M. and Hinojosa-Arango, G. THE ARID MANGROVE FOREST FROMA BAJA CALIFORNIA PENINSULA. Environmental Research Advances. 190 p.
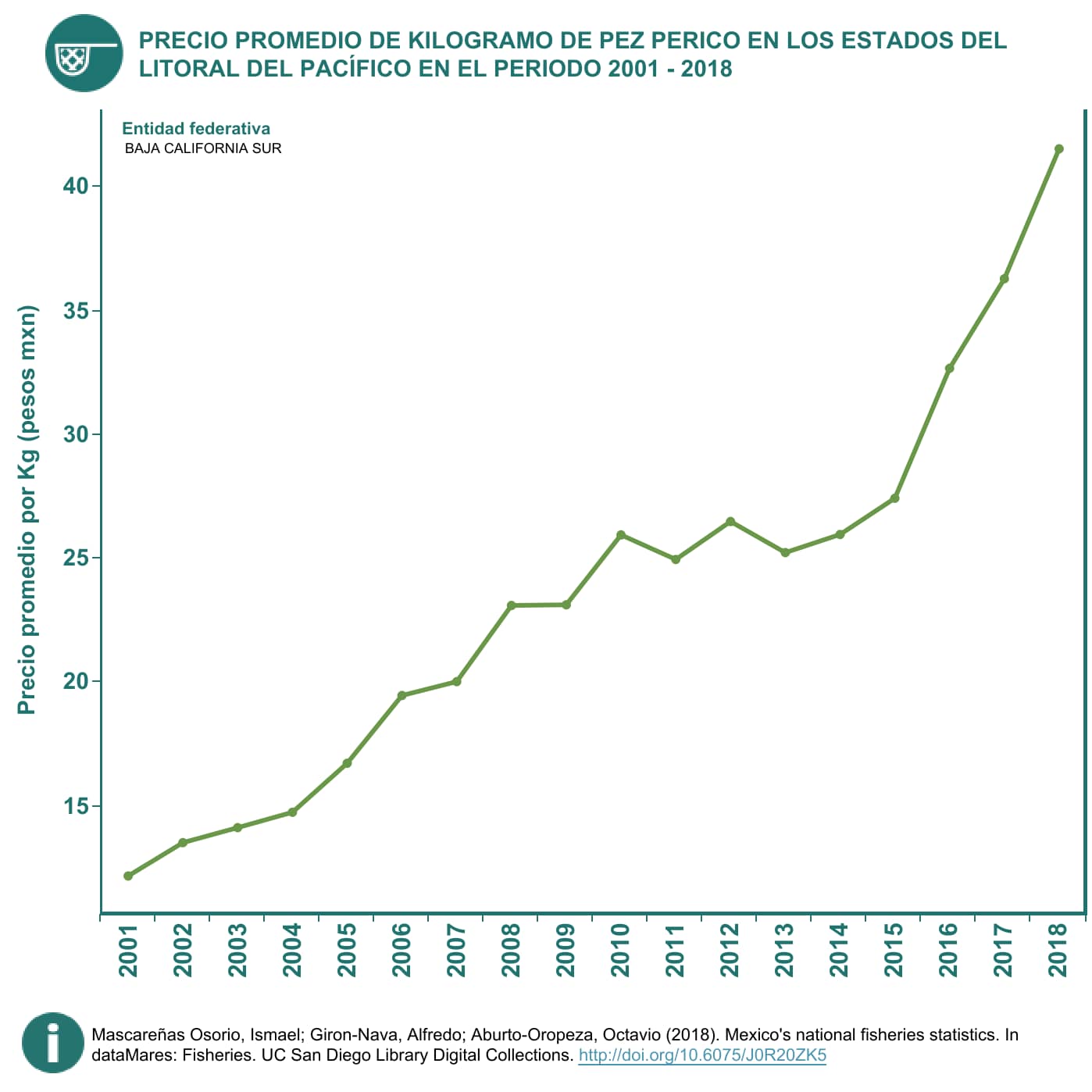
Mascareñas-Osorio, I., Giron-Nava, A. y Aburto-Oropeza, O. 2018. Mexico’s national fisheries statistics. In dataMares: Fisheries. UC San Diego Library Digital Collections. http://doi.org/10.6075/J0R20ZK5
Aburto-Oropeza, O., Paredes, G., Mascareñas-Osorio, I. y Sala, E. 2010. Climatic influence on reef fish recruitment and fisheries. Marine Ecology Progress Series. Vol. 410: 283-287 p
Erisman, B., Mascareñas, I., Paredes, G., Sadovy de Mitcheson, Y., Aburto-Oropeza, O. y Hastings, P. 2010. Seasonal, annual, and long-term trends in commercial fisheries for aggregating reef fishes in the Gulf of California, Mexico.Fisheries Research. 106: 279-288 p.
Domínguez-Sánchez, S. 2019. Fishing vessel permits in Mexico. In dataMares: Fisheries. UC San Diego Library Digital Collections. http://doi.org/10.6075/J0125R1W
Instituto Nacional de la Pesca. 2000. Catálogo de los Sistemas de Captura de las Principales Pesquerías Comerciales. México. 139 pp.
FAO. 2016. El estado mundial de la pesca y la acuicultura 2016. Contribución a la seguridad alimentaria y la nutrición para todos. Roma. 224 pp.
Costa, M.T., Salinas de León, P., Rastoin, E., Cota-Nieto, J., Mascareñas-Osorio, I., Cavole, L., Ramírez-Valdez y Aburto-Oropeza, O. 2017. Manglares distantes comparten comunidades de peces similares, mientras que manglares vecinos pueden ser diferentes. dataMares. InteractiveResource. http://doi.org/10.13022/M3901J
Costa, M.T., Dominguez-Guerrero, I., Cota-Nieto, J., Ezcurra, E. y Aburto-Oropeza, O. 2015. Los manglares son productores de pargos. dataMares. InteractiveResource. http://dx.doi.org/10.13022/M3F30F
Aburto-Oropeza, O., Cota-Nieto, J., Dominguez-Guerrero, I., Giron-Nava, A. y Costa, M.T. 2015. Cómo la distancia entre los manglares y los arrecifes podría afectar a las poblaciones de pargo. dataMares. InteractiveResource. http://dx.doi.org/10.13022/M3T88M